Intuitiv, schnell und immer aktuell - jetzt Handelsblatt App installieren.
Finanzvergleich AnzeigeSoftwarevergleich Anzeige


Die Gentherapie gilt als Schlüssel für die Bekämpfung bisher unheilbarer Krankheiten. Statt klassisch Arzneien zu verabreichen, ermöglicht dabei ein eingeschleustes Gen dem Körper, die benötigten Proteine selbst zu produzieren. Aktuell verfolgen Forscher unter anderem einen vielversprechenden Ansatz zur Therapie der Bluterkrankheit Hämophilie A.

Quelle: Bayer/Shutterstock
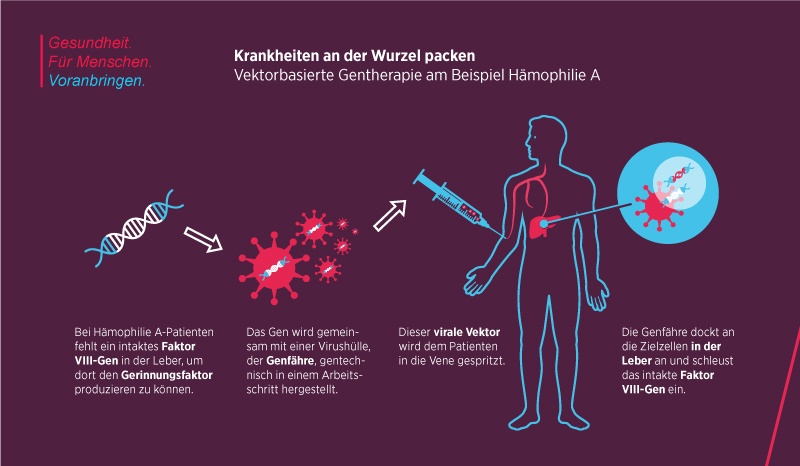
Eine Unachtsamkeit und schon ist es geschehen: ein kleiner Kratzer bei der Gartenarbeit oder ein Hautschnitt beim Rasieren. Was für die meisten Menschen völlig harmlos ist, kann für Hämophilie-Patienten lebensbedrohlich sein. Aufgrund eines Gen-Defektes gerinnt ihr Blut nicht, kann deshalb stundenlang aus einer Wunde sickern. Um das zu verhindern, müssen sich die weltweit etwa 320.000 sogenannten Bluter regelmäßig den Gerinnungsfaktor VIII (FVIII) in die Vene spritzen, jenes Protein, das ihre Leber selbst nicht produzieren kann.

Prof. Dr. Hildegard Büning
Professorin für Infektionsbiologie des Gentransfers an der Medizinischen Hochschule Hannover
Hämophilie A ist eine monogenetische Erkrankung. Nur ein einziges, in diesem Fall gut erforschtes Gen ist defekt -und damit ist die Erbkrankheit prädestiniert für eine Gentherapie. „Das Grundkonzept dieser Therapie beruht auf einem einfachen Sachverhalt: Fehlt ein Gen oder ist es defekt, fehlt ein Protein mit einer bestimmten Funktion im Körper“, sagt Professorin Dr. Hildegard Büning, Biologin und stellvertretende Direktorin des Instituts für Experimentelle Hämatologie an der Medizinischen Hochschule Hannover. „Daher schleusen wir bei der Gentherapie eine funktionierende Kopie des defekten Gens in die Zelle ein, die dessen Funktion übernimmt.“
Statt bei Hämophilie-Patienten ein Leben lang wiederholt den Gerinnungsfaktor zu spritzen, wollen Forscher des Pharmakonzerns Bayer mit einer Gen-Injektion die Leber in die Lage versetzten, den Faktor VIII zu produzieren und so für eine normale Blutgerinnungsfunktion des Körpers zu sorgen. „Wir verlagern durch den Genersatz die Produktion dieses Proteins in den Körper des Patienten, dorthin, wo sie bei gesunden Menschen auch stattfindet“, sagt Dr. Frank Reetz, Programmleiter bei der Bayer-Division Pharmaceuticals. Bisher gehen die Forscher davon aus, dass damit der Faktor-VIII-Mangel über viele Jahre ausgeglichen werden kann.

Dr. Frank Reetz
Global Program Head (Hemophilia), Bayer AG
Ein Taxi bringt das Gen zur defekten Zelle
Damit das Gen sein definiertes Ziel in der Leber auch erreicht, wird ein Transportmittel benötigt. „Den Transport übernehmen sogenannte Vektoren oder Genfähren, wie sie auch genannt werden. Ich spreche gerne von Taxis“, sagt Professorin Brüning. Tatsächlich sind diese Taxis z.B. modifizierte Viren. In diesem Fall auf Basis sogenannter adeno-assoziierter Viren (AAV). Hat das Taxi die Nähe seines Zieles erreicht, nimmt es mit Rezeptoren auf der Zellmembran Kontakt auf. „Diesen Vorgang können wir im Labor mit dafür entwickelten Techniken beobachten“, berichtet Professorin Büning: „Es erinnert an das Anklopfen an eine Tür. Passt alles zusammen, werden die Vektoren in die Zelle aufgenommen und innerhalb von Endosomen, kleinen intrazellulären Bläschen, in Richtung Zellkern transportiert.“ Dort werde die therapeutisch relevante Erbinformation eingeschleust.
Krankheiten wirklich an der Wurzel packen
„Unser Ansatz sieht sehr vielversprechend aus“, sagt Dr. Reetz, „klinische Tests der Phase I/II laufen aktuell an Hämophilie A Patienten. “ Der Bayer-Forscher spricht von „wirklich lebensverändernden Therapien“. Gentherapie ermögliche, Krankheiten an der Wurzel zu packen und eine Heilung oder Regeneration herbeizuführen. Nach Ansicht von Professorin Büning entfalten Therapien mit AAV-Vektoren das größte Potenzial bei sich wenig oder nicht teilenden Organen wie Muskeln, Leber, Gehirn und Augen, aber auch am Herz-Kreislauf-System: „Oftmals handelt es sich um seltene Erkrankungen, bei denen wir mit konventioneller Medizin keine Möglichkeit haben, den Menschen zu helfen.“
In Europa sind bisher sieben Gentherapien zugelassen worden: Zum Beispiel zum Einsatz bei einer Form der Immunschwäche, bei einer angeborenen Form der Blindheit, bei erblichem Muskelschwund. Seit gut einem Jahr dürfen austherapierte Patienten mit sogenannten CAR-T-Zelltherapien gegen aggressive Formen von Blutkrebs behandelt werden. In der Onkologie sieht die Biologin weitere Einsatzbereiche: „Auch da gibt es Veränderungen, einen Defekt, der die Krebszelle wuchern lässt.“ Mit Hilfe eines Vektors können Immunzellen lernen, Tumorzellen zu erkennen. Büning: „Zahlreiche weitere Therapien sind in der Entwicklung. In diesem Jahrzehnt werden wir viele Zulassungen sehen!“