Intuitiv, schnell und immer aktuell - jetzt Handelsblatt App installieren.
Finanzvergleich AnzeigeSoftwarevergleich Anzeige


Nur einer von 10.000 Wirkstoffen, die Forscher im Labor herstellen, wird mal ein Medikament – vielleicht. Denn Arzneimittel-Forschung ist nicht nur teuer und langwierig, sie ist auch eine Reise mit ungewissem Ausgang.

Quelle: Bayer/Getty Images
Auch wenn sich hierzulande das öffentliche Leben allmählich wieder normalisiert – die Bedrohung durch Covid-19 bleibt akut. Denn noch fehlt es an einem Impfstoff gegen das Corona-Virus oder wirksamen Medikamenten gegen die Erkrankung. Weltweit arbeiten Forscher mit Hochdruck an entsprechenden Entwicklungen, doch die Suche ist alles andere als leicht.
Denn bis aus einem potenziellen Wirkstoff ein fertiges Medikament in der Apotheke geworden ist, müssen forschende Pharmaunternehmen wie Bayer einen weiten Weg zurücklegen. Einen Weg mit vielen Umwegen und Abzweigungen, von denen die meisten als Sackgasse enden.
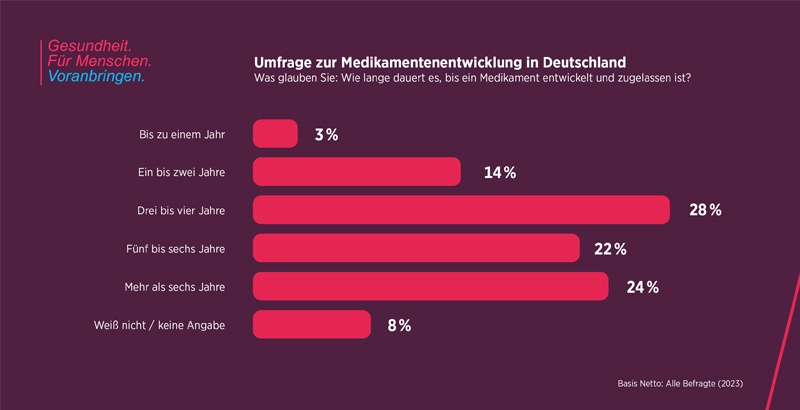
Entsprechend zeitaufwändig und kostspielig ist die Medikamentenentwicklung: Von der ersten Idee bis zur Marktreife können bis zu 12 Jahre vergehen. Präparate für Säuglinge und Kinder benötigten oft bis zu 15 Jahre. Je weiter die Entwicklung voranschreitet, desto teurer werden die einzelnen Entwicklungsphasen. „Am Ende stehen nicht selten Investitionen von zwei Milliarden Euro zu Buche“, sagt Jörg Möller, verantwortlich für die weltweite Forschung und Entwicklung der Pharma-Division bei Bayer.

Dr. Jörg Möller
Head of Global R&D and Member of the Pharmaceuticals Executive Committee at Bayer AG
Ein technologisch wie finanziell riskantes Geschäft
Der Erfolg ist dabei keineswegs garantiert. Öfter als man denken mag, führt der Weg nicht zum gewünschten Ziel, nämlich eine Arznei zu entwickeln, die die Lebensqualität von Patienten entscheidend verbessert und dabei alle Anforderungen an Wirksamkeit und Sicherheit erfüllt. „Wir müssen stets davon ausgehen, dass ein neues Medikament, das in die letzte Phase der klinischen Erprobung am Menschen eintritt, auch dort noch eine 40-prozentige Wahrscheinlichkeit hat, zu scheitern“, so Möller. Medikamenten-Entwicklung ist ein technologisch wie finanziell riskantes Geschäft – und stellt die Menschen, die sie betreiben, immer wieder vor die Aufgabe, sich trotz Rückschlägen neu zu motivieren.
Rund 7.500 Mitarbeiter forschen bei Bayer weltweit nach unentdeckten Wirkstoffen und entwickeln daraus neue Medikamente. Das Ziel: Krankheiten kurieren, Leiden lindern, Menschen helfen. Dieses Bestreben treibt auch Richard Nkulikiyinka an. Der Internist und Epidemiologe arbeitet seit fast 13 Jahren bei Bayer und ist Leiter des Therapiebereichs Herz- und Nierenerkrankungen. Medikamentenentwicklung ist für ihn eine Herzensangelegenheit. Zu Beginn seiner medizinischen Karriere arbeitete Nkulikiyinka als Assistenzarzt in einer Notaufnahme und erlebte tagtäglich, welche Bedeutung Arzneimittel haben.

Dr. Richard Nkulikiyinka
Head of Therapeutic Area Cardiology and Nephrology at Bayer AG, Pharmaceuticals Divison
„Ich habe viele Patienten gesehen, die sehr krank waren, etwa mit schweren Herzproblemen oder akuten Asthmaanfällen“, erzählt er. „Dagegen gibt es bewährte Medikamente, die die Beschwerden verringern. Da hatte ich immer das Gefühl, den Patienten und deren Angehören etwas Gutes getan zu haben.“ Irgendwann fragte sich der Mediziner, wie das Gefühl wohl für denjenigen sein müsse, der solche Medikamente entwickelt. Also beschloss Nkulikiyinka, dem Krankenhaus den Rücken zukehren und in die Forschung zu gehen.
Teamfähigkeit ist gefragt
Seitdem hilft er nicht mehr nur beim Notfall in der Klinik, sondern forscht für Menschen auf der ganzen Welt. Bereut hat der Mediziner diesen Schritt nie – im Gegenteil: „Medikamentenentwicklung ist ein Job, der mit großen Hoffnungen und Möglichkeiten verknüpft ist. Wenn es uns gelingt, ist es ein Fortschritt für die Patienten im Einzelnen und die Medizin im Ganzen. Das allein ist Motivation genug, mich jeden Tag aufs Neue der Herausforderung zu stellen.“
Neugier, Forscherdrang, den Dingen auf den Grund gehen wollen: Diese Eigenschaften zeichnen die Medikamentenentwickler bei Bayer aus. Dazu kommt ein hohes Maß an Teamfähigkeit. „Sie haben es mit Top-Experten in der ganzen Welt zu tun, mit richtigen Könnern ihres Fachs“, sagt Jörg Möller. „Mit denen gemeinsam Probleme zu lösen und sich auszutauschen, macht einfach richtig Spaß.“
Richard Nkulikiyinka stimmt dem zu: „Unser Geschäft ist kollaborationsgetrieben.“ Der Blick von außen auf die Pharmaindustrie sehe wohl eher den Wettbewerb der Firmen untereinander. „Den gibt es natürlich – aber in einem guten Sinne. Alle haben ein Interesse, die Entwicklung neuer Medikamente gemeinsam voranzubringen. Das ist eine Kombination, die ich hervorragend finde“, betont Nkulikiyinka.
Auch das Scheitern schafft neue Erkenntnisse
Findet die lange Suche nach einem neuen Medikament ein erfolgreiches Ende, freut das die Forscher besonders. Erst kürzlich konnten Richard Nkulikiyinka und sein Team die Zulassung eines Medikaments erleben, an dessen Entwicklung sie maßgeblich beteiligt waren. „Wir sind sehr stolz, dass wir es geschafft haben, die Entwicklung innerhalb von zehn Jahren abzuschließen“, sagt er und verweist auf beeindruckende Zahlen: 8000 Probanden und Patienten durchliefen insgesamt 35 Einzelstudien in 50 Ländern.

Vom Molekül zum Medikament
Ein neues Medikament auf den Markt zu bringen ist nicht leicht. So kommen neue Arzneimittel in die Apotheken.
Es ist nicht das erste Medikament, das Nkulikiyinka mit Erfolg durch klinische Tests begleitet und bei den Arzneimittelbehörden eingereicht hat. Das sei umso bemerkenswerter, da die Erfolgsaussichten in der Pharmabranche eher gering sind, räumt Jörg Möller ein. „Wir haben bei Bayer viele durchaus erfolgreiche Kolleginnen und Kollegen, denen es während ihres Berufslebens nie gelingt, ein Medikament auf den Markt zu bringen. Dennoch machen sie einen guten, wichtigen Job.“ Denn jedes Scheitern schafft neue Erkenntnisse, die dazu beitragen, es beim nächsten Mal anders und besser zu machen.
Eine hohe innere Motivation, niemals aufzugeben, ist für Möller eine entscheidende Eigenschaft aller in der Medikamentenentwicklung Tätigen – ebenso wie die Fähigkeit, mit Rückschlägen umgehen zu können. Denn längst nicht alle biologischen Prozesse im menschlichen Körper sind bereits komplett verstanden. „Wenn wir handwerklich alles richtig gemacht haben und ein Medikament verlieren, weil wir an der Biologie scheitern, muss ich das akzeptieren - und hoffen, dass wir die Biologie zukünftig besser verstehen.“
Hinzu kommt, dass sich Medikamentenentwicklung traditionell stark auf niedermolekulare Substanzen stützt, also kleine, chemisch hergestellte Moleküle, die an Proteinen ihre Wirkung entfalten. Rund 80 Prozent aller zugelassenen Arzneimittel funktionieren auf diese Weise. „Es ist aber auch die Realität“, sagt Möller, „dass 80 Prozent des menschlichen Proteoms, die Gesamtheit aller Eiweiße im Körper, gar nicht für diese kleinen Moleküle zugänglich ist. Mit dieser Technologie können wir also tatsächlich bisher nur auf einen Bruchteil der potenziellen Ansatzpunkte bei Krankheiten abzielen.“
Drei Milliarden Euro pro Jahr für Forschung und Entwicklung
Deshalb erforscht Bayer auch neue Verfahren, die den Bereich der üblichen therapeutischen Ansatzpunkte erweitern können. Zum Beispiel die sogenannte RSM-Technologie (RNA-targeting Small Molecules), also kleine Moleküle, die an dem Erbgutmolekül RNA angreifen, um Krankheitsprozesse bereits auf Ebene der Proteinsynthese zu unterbinden und dadurch wichtige Signalwege zu blockieren. Oder sogenannte PROTAC- Technologien (Proteolysis Targeting Chimera), bei denen krankheitserzeugende Eiweiße nicht in ihrer Funktion gehindert, sondern vom Körper direkt abgebaut und unschädlich gemacht werden. Aber auch die Zell- und Gentherapie sind Ansätze, die das Unternehmen verfolgtRund drei Milliarden Euro gibt Bayer jedes Jahr für Forschung und Entwicklung aus und arbeitet auch mit Partnern zusammen, die auf den beschriebenen Gebieten über besondere Expertise verfügen. Die Motivation: neue Antworten auf bekannte, aber noch offene Fragen finden.
Gemeinsam an einem Strang ziehen, neue Wege beschreiten und trotz aller Widrigkeiten niemals aufhören – so könnte man den Leitgedanken von Bayer bei der Medikamentenentwicklung zusammenfassen. Oder wie Richard Nkulikiyinka es sagt: „Egal wie erfolgreich du bist: Da draußen gibt es immer noch Menschen, deren medizinisches Problem nicht gelöst ist. Das ist der Ansporn, immer weiter zu machen.“